Kamis, 05 Agustus 2021
Rabu, 20 Januari 2021
MATERI IPA TERAPAN (KAMIS, 21 JANUARI 2021)
Assalamu'alaikum. wr.wb.Selamat pagi siswa/i SMKN 1 Setu. Semoga semuanya dalam keadaan sehat wal'afiat.Sebelum memulai PJJ hari ini (Kamis, 21 Januari 2021), silahkan berdo'a terlebih dahulu dan mengisi absensi pada link berikut ini.
DAFTAR HADIR IPA TERAPAN
Hari ini Ibu akan membahas materi asam, basa, dan garam. Pada pertemuan sebelumnya, kalian sudah menggolongkan benda-benda ke dalam kelompok asam, basa, dan garam.
Sifat-Sifat Asam, Basa, dan Garam
Istilah asam (acid) berasal dari bahasa Latin "acere" yang berarti masam. Semua senyawa asam memiliki rasa masam pada saat itu. Beberapa diantaranya yaitu cuka, yogurt, dan air perasan lemon. Namun, saat ini mengenali asam dengan mencicipinya tidaklah dianjurkan karena tidak semua senyawa asam aman untuk dicicipi.
Nama Basa (alkali) berasal dari bahasa Arab "al-qily" yang berarti pemanggangan. Nama ini dikenal karena senyawa basa pertama ditemukan pada masa itu, yang merupakan zat pembuat sabun, didapatkan melalui pemanggangan abu dan hasilnya dicampurkan dengan air dan kapur.
Seperti halnya dengan sabun, basa bersifat kaustik (licin), selain itu basa juga bersifat alkali (bereaksi dengan protein di dalam kulit sehingga sel-sel kulit akan mengalami pergantian). Rasa pahit merupakan salah satu sifat zat yang bersifat basa.
Kita dapat mengenali asam dan basa dari rasanya. Namun, kita dilarang mengenali asam dan basa dengan cara mencicipi karena cara tersebut bukan merupakan cara yang aman. Untuk mengidentifikasi asam dan basa yang baik dan aman dapat dengan menggunakan indikator. Indikator yaitu suatu bahan yang dapat bereaksi dengan asam, basa, atau garam sehingga akan menimbulkan perubahan warna.
1. Asam
Asam banyak ditemukan dalam buah-buahan dan sayuran seperti jeruk, lemon, tomat, dan sayuran. Contoh larutan asam adalah cuka, aki kendaraan bermotor, dan asam pada lambung manusia. Ciri-ciri atau tanda dari larutan asam adalah: Rasanya asam (tidak boleh dirasa kecuali dalam makanan); Dapat menimbulkan korosif; Mengubah kertas lakmus biru menjadi merah. Larutan asam bisa menimbulkan dampak negatif bagi lingkungan, contohnya hujan asam berakibat kerusakan pada bangunan gedung dan patung-patung di kota, merusak tumbuh-tumbuhan, mengganggu kehidupan makhluk hidup lain seperti ikan dan insektisida.
Asam merupakan salah satu penyusun dari berbagai bahan makanan dan minuman, misalnya cuka, keju, dan buah-buahan. Menurut Arrhenius, asam adalah zat yang dalam air akan melepaskan ion H+. Jadi, pembawa sifat asam adalah ion H+ (ion hidrogen), sehingga rumus kimia asam selalu mengandung atom hidrogen. Ion adalah atom atau sekelompok atom yang bermuatan listrik. Kation adalah ion yang bermuatan listrik positif. Adapun anion adalah ion yang bermuatan listrik negatif.
Sifat khas lain dari asam adalah dapat bereaksi dengan berbagai bahan seperti logam, marmer, dan keramik. Reaksi antara asam dengan logam bersifat korosif. Contohnya, logam besi dapat bereaksi cepat dengan asam klorida (HCl) membentuk Besi (II) klorida (FeCl2).
Tabel beberapa contoh asam
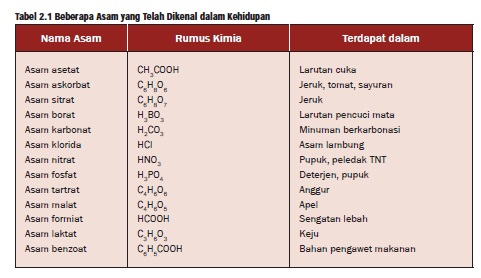
Tabel Asam Kehidupan Sehari-hari
Berdasarkan asalnya, asam dikelompokkan dalam 2 golongan, yaitu asam organik dan asam anorganik. Asam organik umumnya bersifat asam lemah, korosif, dan banyak terdapat di alam. Asam anorganik umumnya bersifat asam kuat dan korosif. Karena sifat-sifatnya itulah, maka asam-asam anorganik banyak digunakan di berbagai kebutuhan manusia.

Buah yang bersifat Asam
2.Basa
Dalam keadaan murni, basa umumnya berupa kristal padat dan bersifat kaustik. Basa adalah suatu senyawa yang jika dilarutkan dalam air (larutan) dapat melepaskan ion hidroksida (OH-). Oleh karena itu, semua rumus kimia basa umumnya mengandung gugus OH. Beberapa produk rumah tangga seperti deodoran, obat maag (antacid),deterjen, sabun mandi, pasta gigi, sampo, dan sabun cuci mengandung basa. Ciri-ciri atau sifat basa adalah: Terasa licin di kulit; Berasa agak pahit; Mengubah kertas lakmus merah menjadi biru. Larutan asam sering direaksikan dengan larutan basa sehingga menghasilkan senyawa netral atau dikenal dengan reaksi netralisasi. Larutan basa akan menetralkan larutan asam dan yang membentuk air (H2O) serta menghasilkan garam. Contoh penerapan reaksi netralisasi dalam kehidupan sehari-hari adalah untuk pengobatan bagi penderita sakit maag, pengobatan untuk sengatan serangga, melindungi kerusakan gigi, dan pengolahan tanah pertanian.
Jika diketahui rumus kimia suatu basa, maka untuk memberi nama basa, cukup dengan menyebut nama logam dan diikuti kata hidroksida.
Tabel beberapa contoh Basa
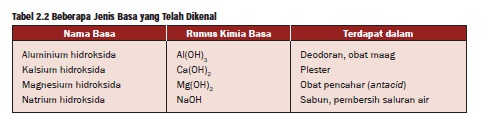
Tabel Basa Kehidupan Sehari-hari
Perbedaan Sifat Asam dan Basa

Perbedaan Sifat Asam Basa3. Garam
Orang mengalami sakit perut disebabkan asam lambung yang meningkat. Untuk menetralkan asam lambung (HCl) digunakan antacid. Antacid mengandung basa yang dapat menetralkan kelebihan asam lambung (HCl).Senyawa garam terbentuk karena reaksi netralisasi yaitu reaksi asam dan basa. Contoh reaksi asam dan basa yang membentuk berbagai jenis garam adalah: HCl + NaOH -> NaCl + H2O
Penggunaan garam dalam kehidupan sehari-hari adalah untuk industri pupuk, obat-obatan, pengolahan makanan dan bahan pengawet. Jenis senyawa garam yang paling dikenal adalah garam dapur dengan nama senyawa kimia Natrium Klorida (NaCl).
Umumnya zat-zat dengan sifat yang berlawanan, seperti asam dan basa cenderung bereaksi membentuk zat baru. Bila larutan asam direaksikan dengan larutan basa, maka ion H+ dari asam akan bereaksi dengan ion OH- dari basa membentuk molekul air.
H+ (aq) + OH- (aq) —> H2O (ℓ)
Asam Basa Air
Karena air bersifat netral, maka reaksi asam dengan basa disebut reaksi penetralan.
Ion-ion ini akan bergabung membentuk senyawa ion yang disebut garam. Bila garam yang terbentuk ini mudah larut dalam air, maka ion-ionnya akan tetap ada di dalam larutan. Tetapi jika garam itu sukar larut dalam air, maka ion-ionnya akan bergabung membentuk suatu endapan. Jadi, reaksi asam dengan basa disebut juga reaksi penggaraman karena membentuk senyawa garam.
Mari kita simak contoh reaksi pembentukan garam berikut!
Asam + Basa —> Garam + Air
Asam klorida + Natrium hidroksida —> Natrium klorida + air
HCl (aq) + Na OH (aq) —> Na Cl (aq) + H2O (ℓ)
Asam Basa Garam Air
Walaupun reaksi asam dengan basa disebut reaksi penetralan, tetapi hasil reaksi (garam) tidak selalu bersifat netral. Sifat asam basa dari larutan garam bergantung pada kekuatan asam dan basa penyusunnya.
Garam yang berasal dari asam kuat dan basa kuat bersifat netral, disebut garam normal, contohnya NaCl dan KNO3. Garam yang berasal dari asam kuat dan basa lemah bersifat asam dan disebut garam asam, contohnya adalah NH4 Cl. Garam yang berasal dari asam lemah dan basa kuat bersifat basa dan disebut garam basa, contohnya adalah CH3COONa.
Contoh asam kuat adalah HCl, HNO3, H2SO4. Adapun KOH, NaOH,
Ca(OH)2 termasuk basa kuat.
Tabel beberapa contoh garam
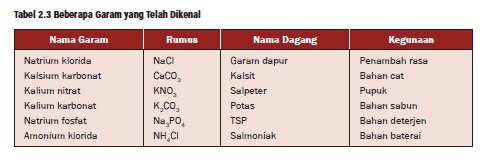
Tabel Garam Kehidupan Sehari-hari
4. Larutan Asam, Basa, dan Garam Bersifat Elektrolit
Ketika seseorang mencari ikan dengan menggunakan ”setrum” atau aliran listrik yang berasal dari aki, apa yang terjadi setelah beberapa saat ujung alat yang telah dialiri arus listrik itu dicelupkan ke dalam air sungai? Ternyata ikan yang berada di sekitar ujung alat itu terkena aliran listrik dan pingsan atau mati.
Apakah air dapat menghantarkan listrik?
Sebenarnya air murni adalah penghantar listrik yang buruk. Akan tetapi bila dilarutkan asam, basa, atau garam ke dalam air maka larutan ini dapat menghantarkan arus listrik. Zat-zat yang larut dalam air dan dapat membentuk suatu larutan yang menghantarkan arus listrik dinamakan larutan elektrolit. Contohnya adalah larutan garam dapur dan larutan asam klorida. Zat yang tidak menghantarkan arus listrik dinamakan larutan nonelektrolit. Contohnya adalah larutan gula dan larutan urea.
Sifat-Sifat Asam, Basa, dan Garam
Istilah asam (acid) berasal dari bahasa Latin "acere" yang berarti masam. Semua senyawa asam memiliki rasa masam pada saat itu. Beberapa diantaranya yaitu cuka, yogurt, dan air perasan lemon. Namun, saat ini mengenali asam dengan mencicipinya tidaklah dianjurkan karena tidak semua senyawa asam aman untuk dicicipi.
Nama Basa (alkali) berasal dari bahasa Arab "al-qily" yang berarti pemanggangan. Nama ini dikenal karena senyawa basa pertama ditemukan pada masa itu, yang merupakan zat pembuat sabun, didapatkan melalui pemanggangan abu dan hasilnya dicampurkan dengan air dan kapur.
Seperti halnya dengan sabun, basa bersifat kaustik (licin), selain itu basa juga bersifat alkali (bereaksi dengan protein di dalam kulit sehingga sel-sel kulit akan mengalami pergantian). Rasa pahit merupakan salah satu sifat zat yang bersifat basa.
Kita dapat mengenali asam dan basa dari rasanya. Namun, kita dilarang mengenali asam dan basa dengan cara mencicipi karena cara tersebut bukan merupakan cara yang aman. Untuk mengidentifikasi asam dan basa yang baik dan aman dapat dengan menggunakan indikator. Indikator yaitu suatu bahan yang dapat bereaksi dengan asam, basa, atau garam sehingga akan menimbulkan perubahan warna.
1. Asam
Asam banyak ditemukan dalam buah-buahan dan sayuran seperti jeruk, lemon, tomat, dan sayuran. Contoh larutan asam adalah cuka, aki kendaraan bermotor, dan asam pada lambung manusia. Ciri-ciri atau tanda dari larutan asam adalah: Rasanya asam (tidak boleh dirasa kecuali dalam makanan); Dapat menimbulkan korosif; Mengubah kertas lakmus biru menjadi merah. Larutan asam bisa menimbulkan dampak negatif bagi lingkungan, contohnya hujan asam berakibat kerusakan pada bangunan gedung dan patung-patung di kota, merusak tumbuh-tumbuhan, mengganggu kehidupan makhluk hidup lain seperti ikan dan insektisida.
Asam merupakan salah satu penyusun dari berbagai bahan makanan dan minuman, misalnya cuka, keju, dan buah-buahan. Menurut Arrhenius, asam adalah zat yang dalam air akan melepaskan ion H+. Jadi, pembawa sifat asam adalah ion H+ (ion hidrogen), sehingga rumus kimia asam selalu mengandung atom hidrogen. Ion adalah atom atau sekelompok atom yang bermuatan listrik. Kation adalah ion yang bermuatan listrik positif. Adapun anion adalah ion yang bermuatan listrik negatif.
Sifat khas lain dari asam adalah dapat bereaksi dengan berbagai bahan seperti logam, marmer, dan keramik. Reaksi antara asam dengan logam bersifat korosif. Contohnya, logam besi dapat bereaksi cepat dengan asam klorida (HCl) membentuk Besi (II) klorida (FeCl2).
Tabel beberapa contoh asam

Tabel Asam Kehidupan Sehari-hari
Berdasarkan asalnya, asam dikelompokkan dalam 2 golongan, yaitu asam organik dan asam anorganik. Asam organik umumnya bersifat asam lemah, korosif, dan banyak terdapat di alam. Asam anorganik umumnya bersifat asam kuat dan korosif. Karena sifat-sifatnya itulah, maka asam-asam anorganik banyak digunakan di berbagai kebutuhan manusia.

Buah yang bersifat Asam
2.Basa
Dalam keadaan murni, basa umumnya berupa kristal padat dan bersifat kaustik. Basa adalah suatu senyawa yang jika dilarutkan dalam air (larutan) dapat melepaskan ion hidroksida (OH-). Oleh karena itu, semua rumus kimia basa umumnya mengandung gugus OH. Beberapa produk rumah tangga seperti deodoran, obat maag (antacid),deterjen, sabun mandi, pasta gigi, sampo, dan sabun cuci mengandung basa. Ciri-ciri atau sifat basa adalah: Terasa licin di kulit; Berasa agak pahit; Mengubah kertas lakmus merah menjadi biru. Larutan asam sering direaksikan dengan larutan basa sehingga menghasilkan senyawa netral atau dikenal dengan reaksi netralisasi. Larutan basa akan menetralkan larutan asam dan yang membentuk air (H2O) serta menghasilkan garam. Contoh penerapan reaksi netralisasi dalam kehidupan sehari-hari adalah untuk pengobatan bagi penderita sakit maag, pengobatan untuk sengatan serangga, melindungi kerusakan gigi, dan pengolahan tanah pertanian.
Jika diketahui rumus kimia suatu basa, maka untuk memberi nama basa, cukup dengan menyebut nama logam dan diikuti kata hidroksida.
Tabel beberapa contoh Basa

Tabel Basa Kehidupan Sehari-hari
Perbedaan Sifat Asam dan Basa

Perbedaan Sifat Asam Basa3. Garam
Orang mengalami sakit perut disebabkan asam lambung yang meningkat. Untuk menetralkan asam lambung (HCl) digunakan antacid. Antacid mengandung basa yang dapat menetralkan kelebihan asam lambung (HCl).Senyawa garam terbentuk karena reaksi netralisasi yaitu reaksi asam dan basa. Contoh reaksi asam dan basa yang membentuk berbagai jenis garam adalah: HCl + NaOH -> NaCl + H2O
Penggunaan garam dalam kehidupan sehari-hari adalah untuk industri pupuk, obat-obatan, pengolahan makanan dan bahan pengawet. Jenis senyawa garam yang paling dikenal adalah garam dapur dengan nama senyawa kimia Natrium Klorida (NaCl).
Umumnya zat-zat dengan sifat yang berlawanan, seperti asam dan basa cenderung bereaksi membentuk zat baru. Bila larutan asam direaksikan dengan larutan basa, maka ion H+ dari asam akan bereaksi dengan ion OH- dari basa membentuk molekul air.
H+ (aq) + OH- (aq) —> H2O (ℓ)
Asam Basa Air
Karena air bersifat netral, maka reaksi asam dengan basa disebut reaksi penetralan.
Ion-ion ini akan bergabung membentuk senyawa ion yang disebut garam. Bila garam yang terbentuk ini mudah larut dalam air, maka ion-ionnya akan tetap ada di dalam larutan. Tetapi jika garam itu sukar larut dalam air, maka ion-ionnya akan bergabung membentuk suatu endapan. Jadi, reaksi asam dengan basa disebut juga reaksi penggaraman karena membentuk senyawa garam.
Mari kita simak contoh reaksi pembentukan garam berikut!
Asam + Basa —> Garam + Air
Asam klorida + Natrium hidroksida —> Natrium klorida + air
HCl (aq) + Na OH (aq) —> Na Cl (aq) + H2O (ℓ)
Asam Basa Garam Air
Walaupun reaksi asam dengan basa disebut reaksi penetralan, tetapi hasil reaksi (garam) tidak selalu bersifat netral. Sifat asam basa dari larutan garam bergantung pada kekuatan asam dan basa penyusunnya.
Garam yang berasal dari asam kuat dan basa kuat bersifat netral, disebut garam normal, contohnya NaCl dan KNO3. Garam yang berasal dari asam kuat dan basa lemah bersifat asam dan disebut garam asam, contohnya adalah NH4 Cl. Garam yang berasal dari asam lemah dan basa kuat bersifat basa dan disebut garam basa, contohnya adalah CH3COONa.
Contoh asam kuat adalah HCl, HNO3, H2SO4. Adapun KOH, NaOH,
Ca(OH)2 termasuk basa kuat.
Tabel beberapa contoh garam

Tabel Garam Kehidupan Sehari-hari
4. Larutan Asam, Basa, dan Garam Bersifat Elektrolit
Ketika seseorang mencari ikan dengan menggunakan ”setrum” atau aliran listrik yang berasal dari aki, apa yang terjadi setelah beberapa saat ujung alat yang telah dialiri arus listrik itu dicelupkan ke dalam air sungai? Ternyata ikan yang berada di sekitar ujung alat itu terkena aliran listrik dan pingsan atau mati.
Apakah air dapat menghantarkan listrik?
Sebenarnya air murni adalah penghantar listrik yang buruk. Akan tetapi bila dilarutkan asam, basa, atau garam ke dalam air maka larutan ini dapat menghantarkan arus listrik. Zat-zat yang larut dalam air dan dapat membentuk suatu larutan yang menghantarkan arus listrik dinamakan larutan elektrolit. Contohnya adalah larutan garam dapur dan larutan asam klorida. Zat yang tidak menghantarkan arus listrik dinamakan larutan nonelektrolit. Contohnya adalah larutan gula dan larutan urea.
MATERI BASA SUNDA (KAMIS, 21 JANUARI 2021)
Assalamu'alaikum
Sateuacan diajar, hayu urang ngadu'a sasarengan. Réngsé ngadua'a, pék ku hidep eusian absen dina link dihandap!
Klik ABSEN PJJ BASA SUNDA
Rabu, 25 November 2020
MATERI IPA TERAPAN 26 NOVEMBER 2020
Assalamu'alaikum. wr.wb.
Selamat pagi siswa/i SMKN 1 Setu.
Semoga semuanya dalam keadaan sehat wal'afiat.
Sebelum memulai PJJ hari ini (Kamis, 26 November 2020), silahkan berdo'a terlebih dahulu dan mengisi absensi pada link berikut ini.
Hari ini Ibu akan melanjutkan materi tentang Larutan.
Simaklah penjelasan berikut ini!
Kelarutan
Setiap zat terlarut memiliki batasan jumlah tertentu untuk dapat melarut. Kemampuan melarut tiap zat dalam pelarut berbeda-beda. Kemampuan ini dinyatakan sebagai kelarutan, yaitu jumlah maksimum zat terlarut yang dapat larut pada pelarut tertentu untuk membentuk suatu larutan homogen. Contohnya Magnesium Klorida dan Natrium Klorida. Kedua senyawa ini memiliki kelarutan yang besar dalam air. Lain halnya dengan Magnesium Karbonat yang memiliki kelarutan sangat kecil dalam air.
Faktor Yang Mempengaruhi Kelarutan
Faktor Yang Mempengaruhi Kelarutan tergantung pada sebagai berikut :
Sifat solvent
Kelarutan yang besar terjadi bila molekul-molekul solute mempunyai kesamaan dalam struktur dan sifat-sifat kelistrikan dari molekul-molekul solvent. Bila ada kesamaan dari sifat-sifat kelistrikan, misalnya momen dipol yang tinggi, antara solvent-solvent, maka gaya-gaya tarik yang terjadi antara solute solvent adalah kuat. Sebaliknya, bila tidak ada kesamaan, maka gaya-gaya terik solute solvent lemah.
Secara umum, padatan ionik mempunyai kelarutan yang lebih tinggi dalam solvent polar daripada dalam pelarut non-polar. Juga, jika solvent lebih polar, maka kelarutan dari padatan-padatan ionik akan lebih besar.
Suhu
Kelarutan gas dalam air biasanya menurun jika suhu larutan dinaikkan. Gelembung-gelembung kecil yang dibentuk bila air dipanaskan adalah kenyataan bahwa udara yang terlarut menjadi kurang larut pada suhu-suhu yang lebih kecil. Hal yang serupa, tidak ada aturan yang umum untuk perubahan suhu terhadap kelrutan cairan-cairan dan padatan-padatan.
Tekanan
Kelarutan dari semua gas naik jika tekanan saham dari gas yang terletak di atas larutan dinaikkan. Secara kuantitatif, hal ini dinyatakan dalam hukum Henry, yang menyatakan bahwa pada suhu tetap perbandingan dari tekanan saham dari solute gas dibagi dengan mol fraksi dari gas dalam larutan adalah tetap.
Konsentrasi Larutan
Konsentrasi larutan merupakan cara untuk menyatakan hubungan kuantitatif antara zat terlarut dan pelarut.
Beberapa istilah yang sering digunakan dalam pembahasan larutan:
Konsentrasi : jumlah zat terlarut tiap satuan volume larutan
Volume larutan : jumlah volume pelarut ditambah volume zat terlarut
Larutan encer : Jumlah zat terlarut sangat sedikit
Larutan pekat : Jumlah zat terlarut sangat banyak
Untuk menyatakan konsentrasi larutan, banyak jenis satuan yang bisa kamu gunakan, yang bergantung terhadap preferensi atau sudut pandang di antaranya molaritas, molalitas, fraksi mol, persen massa, dan persen volume. Adapun penjelasan dari besaran konsentrasi larutan ini di antaranya adalah:
1. Kemolaran
Kemolaran atau molaritas adalah satuan konsentrasi dari larutan yang dapat menunjukkan jumlah mol dari zat terlarut di dalam satu liter larutan. Adapun molaritas dapat dinyatakan dalam persamaan:
![]()
2. Molalitas
Molalitas atau kemolalan hampir mirip dengan molaritas, namun ada yang membedakan yaitu besaran pelarutnya. Jika molaritas menggunakan besaran pelarut dalam volume, molalitas menghitung konsentrasi dengan perbandingan mol di dalam satuan berat atau dalam satu kilogram pelarut. Adapun persamaan yang dapat digunakan untuk mendapat molalitas adalah:
![]()
Selain menggunakan persamaan tersebut, kamu juga dapat menggunakan persamaan berikut ini:
![]()
3. Fraksi mol
Besaran konsentrasi larutan yang kali ini adalah fraksi mol. Fraksi mol ini dapat menunjukkan perbandingan dari konsentrasi mol zat baik zat terlarut maupun zat pelarut dengan larutan tersebut. Dimana fraksi mol zat terlarut dan zat pelarut jika dijumlahkan akan menjadi 1. Persamaan yang bisa kamu gunakan untuk mendapatkan fraksi mol adalah:
![]()
Dimana:
xt = fraksi mol zat terlarut
nt = mol zat terlarut
xp = fraksi mol zat pelarut
np = mol zat terlarut
4. Persen massa
Jenis besaran konsentrasi larutan yang satu ini memiliki tujuan untuk menunjukkan persentase massa, dimana ada yang membandingkan massa suatu zat terlarut dengan 100 gram larutannya atau biasanya disebut dengan persen massa per massa, dan membandingkan massa suatu zat terlarut dengan volume larutan tersebut.
Persen massa per massa biasanya digunakan untuk mencari kandungan zat terlarut di dalam larutan yang berasal dari fase padat.
Persamaan untuk mencari persen massa per massa adalah:
![]()
Sedangkan untuk mendapatkan persen massa per volume, kamu dapat menggunakan persamaan:
![]()
5. Persen volume
Besaran konsentrasi larutan lainnya adalah persen volume yang membandingkan volume dari zat terlarut dengan volume larutan, dimana biasanya digunakan untuk zat terlarut yang berasal dari fase cair, dengan menggunakan persamaan:
persen volume = volume zat terlarut/volume larutan x 100%
Contoh soal 1
Terdapat 20 mL larutan HCl pekat dengan massa jenis 1,2 g/mL. Jika kadar HCl dalam larutan tersebut sebesar 40%, tentukan massa HCl!
Pembahasan:
Sebelum menentukan massa HCl, Quipperian harus mencari massa larutan HCl dengan persamaan berikut.

Kemudian, tentukan massa HCl dengan cara berikut.

Jadi, massa HCl tersebut adalah 9,6 gram.
Contoh soal 2

Berdasarkan persamaan tersebut, diperoleh:
Mol urea = 1 mol
Mol air = 5 mol
Kemudian, tentukan massa urea dan massa air.

Dengan demikian, molalitas larutan tersebut dirumuskan sebagai berikut.

Jadi, molalitas larutan urea tersebut adalah 11,11 molal.
Contoh soal 3
Sebanyak 100 mL larutan gula 2 M akan dibuat menjadi larutan gula 0,25 M. Tentukan volume larutan setelah diencerkan dan volume air yang harus ditambahkan!
Pembahasan:
Di soal tertulis bahwa larutan gula 2 M akan dijadikan 0,25 M. Artinya, ada penambahan air ke dalam larutan tersebut. Dengan rumus pengenceran, volume larutan setelah diencerkan dirumuskan sebagai berikut.

Dengan demikian, volume air yang harus ditambahkan adalah sebagai berikut.

Jadi, volume larutan gula setelah diencerkan menjadi 800 mL dan volume air yang harus ditambahkan adalah 700 mL.
BASA SUNDA 26 NOVEMBER 2020
Assalamu'alaikum wr.wb.
Sateuacan diajar, hayu urang ngadu'a sasarengan. Réngsé ngadua'a, pék ku hidep eusian absen dina link dihandap!
Klik ABSEN PJJ BASA SUNDA
Upami tos ngeusian absen di luhur, pek ku hidep klik link nu aya di handap!
Hatur nuhun
Rabu, 18 November 2020
Basa Sunda 19 November 2020
Assalamu'alaikum🤗
Sateuacan diajar, hayu urang ngadu'a sasarengan. Réngsé ngadua'a, pék ku hidep eusian absen dina link dihandap!
Klik ABSEN PJJ BASA SUNDA
Materi IPA Terapan 19 November 2020
Assalamu'alaikum. wr.wb.
Selamat pagi siswa/i SMKN 1 Setu.
Semoga semuanya dalam keadaan sehat wal'afiat.
Sebelum memulai PJJ hari ini (Kamis, 19 November 2020), silahkan berdo'a terlebih dahulu dan mengisi absensi pada link berikut ini.
Hari ini Ibu akan membahas materi tentang Larutan.
Larutan
Larutan adalah campuran homogen yang terdiri dari dua atau lebih zat.
Dalam sebuah larutan terdapat zat pelarut dan zat terlarut. Zat terlarut (solute) adalah zat penyusun larutan yang mempunyai jumlah lebih sedikit dalam sebuah larutan. Sedangkan zat pelarut (solvent) adalah zat yang jumlahnya lebih banyak dibandingkan dengan zat terlarut.
Komposisi zat terlaut dalam larutan dinyatakan dengan konsentrasi larutan. Sedangkan proses pencampuran zat terlarut dan pelarut membentuk larutan.
Untuk lebih memahami mengenai larutan, perhatikan gambar ilustrasi berikut.

Terdapat sebuah solute dan solvent. Ketika kedua bahan tersebut dicampur dan menyatu dalam wadah maka jadilah larutan.
Berdasarkan kepolarannya, pelarut dibedakan menjadi pelarut polar dan non polar. Umumnya pelarut polar akan melarutkan senyawa polar. Sebaliknya pelarut non polar akan melarutkan senyawa non polar. Keadaan ini sering disebut dengan istilah like dissolves like.
Air merupakan salahsatu jenis pelarut polar. Air dapat melarutkan alkohol,tetapi tidak dapat melarutkan minyak. Hal ini karena adanya perbedaan kepolaran antara air dan minyak. Alkohol merupakan senyawa polar,sedangkan minyak merupakan senyawa non polar. Molekul air tersususun dari 2 atom Hidrogen dan 1 atom Oksigen. Atom Oksigen bersifat lebih elektronegatif dibandingkan atom Hidrogen. Akibatnya , dalam ikatan, elektron akan cenderung tertarik ke arah atom Oksigen dan membentuk polarisasi (pengkutuban). Atom Oksigen akan membentuk muatan negatif (dipol negatif) sedangkan atom Hidrogen akan membentuk muatan positif (dipol positif). Karena dapat membentuk polarisasi, air bersifat melarutkan senyawa polar, baik senyawa kovalen polar maupun senyawa ionik.
Selain air, berikut ini ada beberapa contoh pelarut dan kegunaannya.
Silakan pelajari materi tersebut, kemudian catat di buku kalian masing-masing.
Terima kasih
Rabu, 11 November 2020
Ulangan Harian IPA Terapan
Assalamu'alaikum. wr.wb.
Selamat pagi siswa/i SMKN 1 Setu.
Semoga semuanya dalam keadaan sehat wal'afiat.
Sebelum memulai PJJ hari ini (Kamis, 12 November 2020), silahkan berdo'a terlebih dahulu dan mengisi absensi pada link berikut ini.
Jadwal hari ini yaitu Ulangan Harian.
Silakan isi soal ulangan harian pada link berikut







